Construyendo teóricamente mi primer biorreactor (ciclo del azufre)
Introducción
La mayor parte del azufre de nuestro planeta, se encuentra en sedimentos y rocas en forma de minerales de sulfato, principalmente como yeso ( Ca SO4 ) y minerales de sulfuro (pirita,Fe S2), aunque el mar constituye el principal reservorio de sulfato de la biósfera. Una parte significativa de azufre particularmente el dióxido de azufre (SO2 gas ), se incorpora al ciclo de azufre mediante la actividad humana, sobre todo por combustión de combustibles fósiles.
El sulfuro de hidrógeno (HS- )o ( H2S ) es el principal gas volátil del azufre. Esta sustancia se forma principalmente por reducción bacteriana de sulfato
(SO42- +4H2 H2S +2 H2O + 2OH- ) o por las emisiones geoquímicas o por las emisiones geoquímicas de fuentes de sulfuro y volcanes. Aunque el( H2S ) es volátil, la forma de sulfuro presente en el ambiente depende del pH: por debajo de valores de pH 7 predomina el ( H2S ) y por encima de 7 predominan las formas no volátiles el ( SH-) y el (S2- ). En conjunto el ( H2S ), ( SH-) y el (S2- ) se denominan como sulfuros. El ( H2S ) es tóxico para muchas plantas y animales, cuando se combina con el hierro de los citocromos, bloquea la respiración, por lo cual el sulfuro es considerado tóxico. Su formación usualmente es a partir de la reducción de sulfato. La detoxificación en el ambiente del ( H2S ) se lleva a cabo mediante la reacción con compuestos de hierro, para formar (Fe S )pirrotina y ( FeS2 )pirita. El color negro de muchos sedimentos sulfúricos o de los cultivos de bacterias reductoras de sulfato se debe a estos minerales de sulfuros metálicos donde se produce sulfato reducción se debe a la acumulación de FeS.
Se realizó una búsqueda en el manual de Bergeys y se identificó a dos posibles cepas idóneas para la oxidación de sulfuro a sulfatos y al mismo tiempo se disminuya el PH.
Objetivo
Sabiendo que el (HS-) o ( H2S ) es tóxicos para muchas plantas y animales se Identificará una cepa bacteriana, que ayude a estabilizarlos bioquímicamente transformándolos en (SO42-), así como elevación y se puedan incorporar al suelo de los cultivos haciéndolos más productivos.
Método
Se encontraron dos cepas bacterianas, que ayudan a transformar a través de la oxidación el (SO42-) a ( H2S ), así como elevación de su PH.

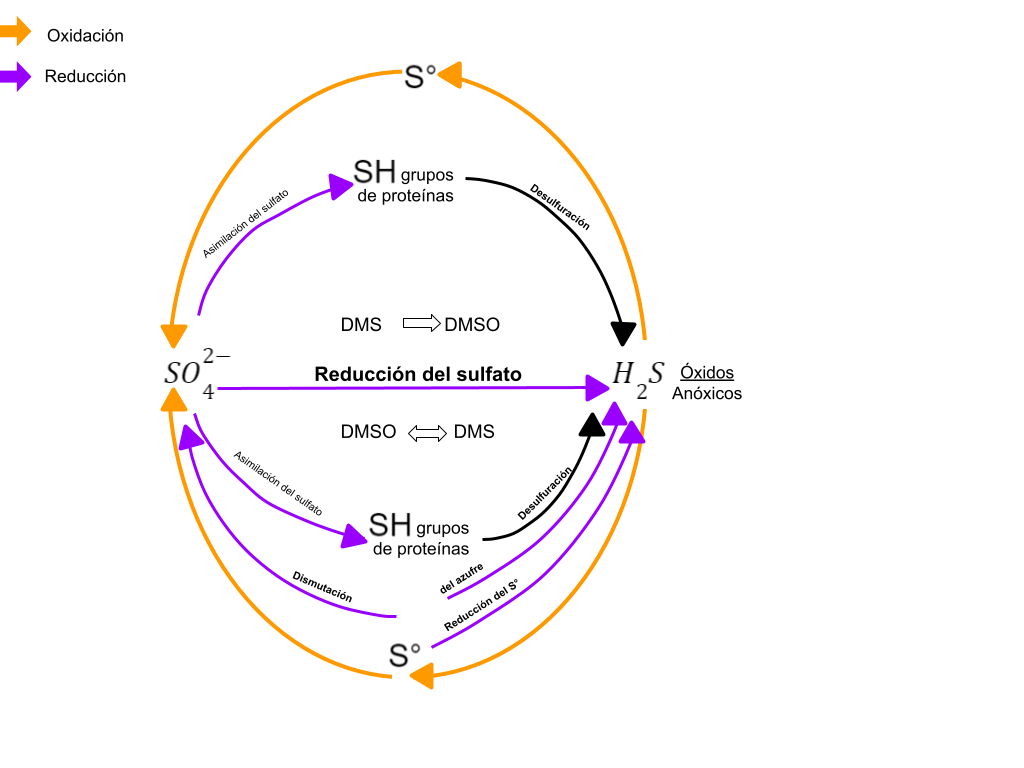
Bioquímica (metabolismo del azufre)

Revisión taxonómica
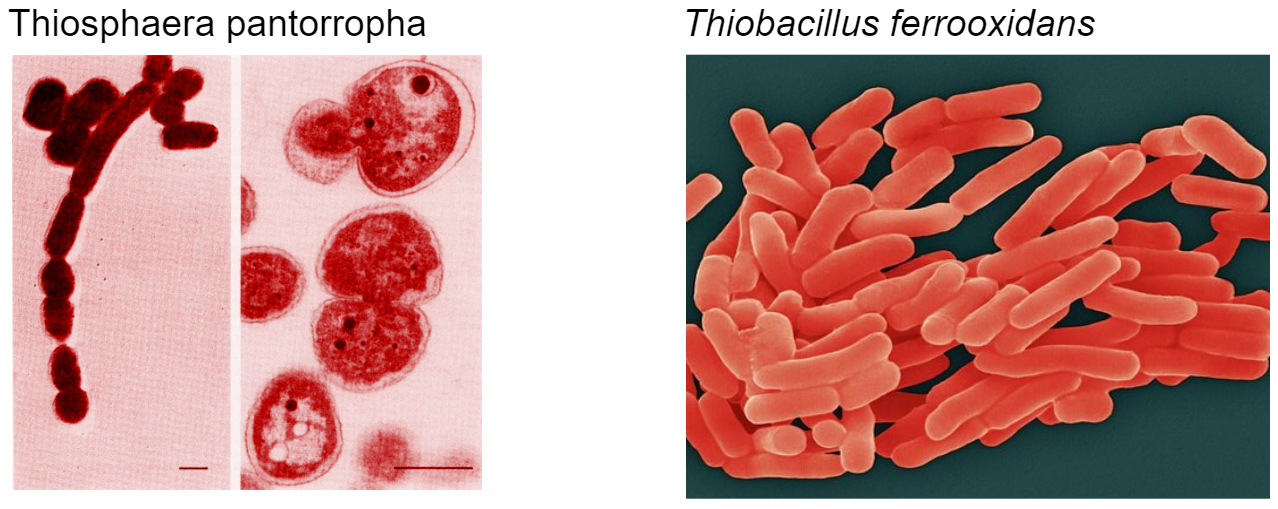
Especies elegidas para construcción de biorreactor:


Método para elaborar un biorreactor que transforme de ( H2S ) a (SO42-) y eleve los niveles de PH
- Se seleccionan dos bacterias Thiosphaera pantorropha y Thiobacillus ferrooxidans capaces de oxidar el sulfuro y transformarlo a sulfato, así como elevar PH.
- Se aíslan 6 tubos bacteriológicos de cada cepa acorde a su medio de cultivo, en el caso de las Thiobacillus ferrooxidans se elige un medio de cultivo acuoso rico en arsénico y azufre para su crecimiento. Para la Thiosphaera pantorropha se usa un agua rica en azufre.
- Se deja incubar a temperatura ambiente.
- Posterior se elige un medio de cultivo:
- Agar Xilosa Lisina Desoxicolato (XLD), revelan la formación de ácido sulfhídrico (H2S) por la precipitación de sulfuro de férrico (Fe2S3) de color negro presente en las colonias; el viraje es de color rojo púrpura alrededor de las colonias cuando existe un aumento de PH
- Con las muestras de las cajas de Petri que cambiaron su viraje y dieron positivas a lo buscado, se aplica tinción gram y se hace una tabla de caracterización.
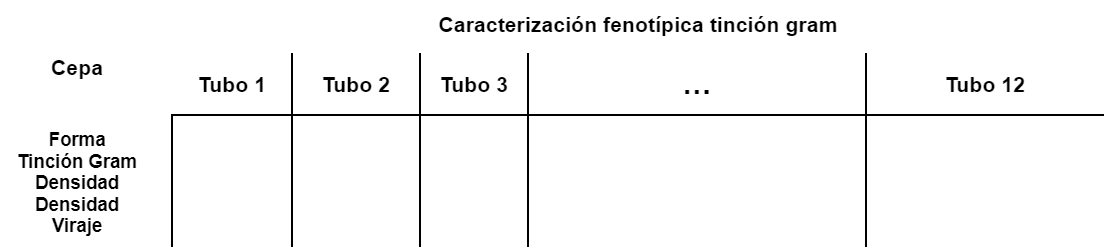
- Identificar morfotipos (rasgos genotípicos para decidir qué línea se escoge de progenitores para hacer la conjugación).
- Se deja incubar a temperatura ambiente y nuevamente se inoculan en los medios de cultivo previamente seleccionados.
- Se hace una tabla de caracterización y se eligen las cepas que se van a poner a prueba.
- Planificación de la prueba reto, donde se añada la bacteria a un medio controlado acuoso donde normalmente existen emisiones altas de ( H2S ) y un PH bajo.
- Cuantificación de ( H2S ) y (SO42-) antes y después de comenzar la prueba.
- Teniendo el (SO42-) que se utiliza para la elaboración de biofertilizantes , se ocupan en el suelo de los cultivos ayudando a su productividad.
Conclusión
Se encontraron dos cepas bacterianas, que ayudan a transformar a través de la oxidación el (SO42-) a ( H2S ), así como elevación de su PH.
Discusión de resultados
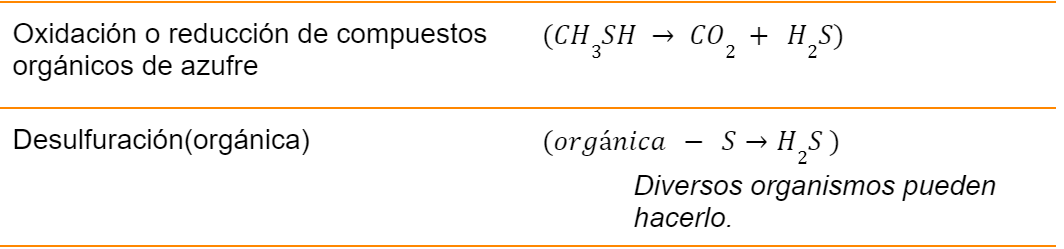
Se documentaron varios medios de cultivo, donde se pudiera medir la oxidación de ( H2S ) y que se transformara a (SO42-), sin embargo el más cercano que nos puede servir para este biorreactor es el Agar Xilosa Lisina Desoxicolato (XLD), aunque no es específica se eligió por que su viraje indica cuando elementos del azúfre bajan el PH cambiando su viraje de negro a rojo morado. Así mismo en la elección de cepas, se documentó de la bacteria paracoccus pantotrophus, que oxida de sulfuro y tiosulfuro y son reducidos a sulfato de azufre y este está formado por más de quince genes que codifican varios citocromos y otras proteínas necesarias para la oxidación directamente a sulfato de compuestos de azufre. Sin embargo a pesar de ser idónea, no se consideró ya que no se encontraba en el manual de Bergey´s.
Referencias
Chandra, T. S., & Friedrich, C. G. (1986). Tn5-induced mutations affecting sulfur-oxidizing ability (Sox) of Thiosphaera pantotropha. j bacteriol, 446–452.
de La Guarda, M. R. H. G. (2021). Análisis genómico de plásmidos de Acidithiobacillus ferrivorans PQ510 y Acidithiobacillus ferrooxidans PQ506 aislados de una zona minera de Cerro de Pasco. Universidad Nacional Mayor de San Marcos.
de Microbiología, I. V. (2012). Bacterias productoras de H2S: importancia en el deterioro de productos pesqueros y cárnicos - Cultivo cualitativo y cuantitativo; identificación molecular (PCR y Secuenciación). Instituto Valenciano de Microbiología.
García de la Guarda, R. H. (2021). Análisis genómico de plásmidos de Acidithiobacillus ferrivorans PQ510 y Acidithiobacillus ferrooxidans PQ506 aislados de una zona minera de Cerro de Pasco - Perú.
HACH. (2023). Prueba BART para bacterias reductoras de sulfato.
Holt, J. G., Krieg, N. R., Sneath, P. H. A., Staley, J. T., & Williams, S. T. (2000). Bergey´s Manual of DETERMINATIVE BACTERIOLOGY (Ninth Edition). Lipincoott wiliams & wilkins.
Lozano, L. C., Ramírez, L. C. C., & Ramírez, L. C. C. (2021). Las bacterias, su nutrición y crecimiento: una mirada desde la química. Nova, 19(36). https://doi.org/10.22490/24629448.5293
Madigan, M. T., Martinko, J. M., & Parker, J. (2004). Brock Biología de los Microorganísmos, 10a Edición. Pearson Prentice Hall.
Mittenhuber, G., Sonomoto, K., Egert, M., & Friedrich, C. G. (1991). Identification of the DNA region responsible for sulfur-oxidizing ability of Thiosphaera pantotropha. J Bacteriol ., 7340–7344.
R,M y Bartha, R. (2002). Atlas Ecología microbiana y Microbiología ambiental. Pearson Prentice Hall.
Universidad Miguel Hernández de Elche. (2013). Producción de sulfhídrico. Prácticas de Microbiología.
Wodara, C., Kostka, S., Egert, M., Kelly, D. P., & Friedrich, C. G. (1994). Identification and sequence analysis of the soxB gene essential for sulfur oxidation of Paracoccus denitrificans GB17. J Bacteriol, 6188–6191.
Anexo

Aunque son posibles varios estados de oxidación (Brock, 2008) refiere que solo tres estados de oxidación, tienen importancia en la naturaleza.
- -2 (sulfidrilo, R-SH y sulfuro HS-)
- 0 ( azufre elemental, S°).
+6 (Sulfato, SO42-).
Sulfuro de hidrógeno y reducción a sulfato